Der Neuroimmunologie auf der Spur
Bericht:
Dr. Alexander Kretzschmar
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Unter dem Motto „Neurologie meets Immunologie“ beschäftigte sich die Jahrestagung der Deutschen Gesellschaft für Neurologie (DGN) in diesem Jahr mit neuroimmunologischen Schlüsselmechanismen zahlreicher neurologischer Erkrankungen, erklärte Kongresspräsident Prof. Sven Meuth, Düsseldorf. Für ihn geht es darum, die Neurologie in ihrer ganzen thematischen Bandbreite darzustellen. Dabei bieten sich durch die Einbeziehung der Immunologie neue Perspektiven für das gesamte Fach, so der Neurologe.
Die Vorträge auf dem Präsidentensymposium machten deutlich, dass Inflammationsprozesse nicht nur an den neurologischen Indikationen beteiligt sind, die als entzündliche Erkrankungen klassifiziert werden. Sie scheinen vielmehr zu den globalen pathophysiologischen Mechanismen vieler neurologischer Erkrankungen zu gehören, beispielsweise Demenzerkrankungen, Hirntumoren oder Schlaganfälle. Daraus ergeben sich therapeutische Überlegungen, auch bei primär nichtentzündlichen neurologischen Krankheiten mit Entzündungsmodulatoren einzugreifen, um neurodegenerative Prozesse zu verzögern oder gänzlich aufzuhalten.
Schneller von der Laborbank zum Krankenbett
Hier liegt nach Ansicht des Kongresspräsidenten ein großes, noch kaum ausgeschöpftes Potenzial für das Fach. Meuth beklagte, dass neurologische Erkrankungen zu sehr voneinander abgegrenzt werden. „Da ist ein Schlaganfall ein Schlaganfall und eine MS eine MS, das eine hat vermeintlich nichts mit dem anderen zu tun. Betrachtet man jedoch die dahinterliegenden pathophysiologischen Mechanismen, erkennt man frappierende Ähnlichkeiten.“ So ist die MS eine inflammatorische Erkrankung, bei der Entzündungsreaktionen zum Nervenzelluntergang führen. Beim Schlaganfall hat man ein thrombosiertes Gefäß, die Nervenzellen werden nicht ausreichend versorgt und gehen unter, was sekundär ebenfalls zu einer Entzündungsreaktion und in der Folge zum Nervenzelluntergang führt. Dies führte zu Überlegungen, Entzündungsmodulatoren wie Natalizumab auch bei primär nichtentzündlichen Erkrankungen einzusetzen. Dieses sogenannte „drug repurposing“ hat den Vorteil, dass bereits Sicherheitsdaten über einige Jahre vorliegen, so der Neurologe.
Neue Perspektiven mit CAR-T-Zell-Therapien
Der Erlanger Rheumatologe Prof. Georg Schett ist einer der Pioniere beim Einsatz von CAR-T-Zell-Therapien nicht nur bei rheumatologischen, sondern auch bei neuroimmunologischen Erkrankungen. Ein Vorteil der CAR-T-Zell-Therapien ist auch, dass trotz der massiven B-Zell-Depletion die Impfantikörper weiterhin nachweisbar sind, weil sie von Plasmazellen kommen und kein CD19 an der Oberfläche exprimieren, erklärte Schett auf dem Präsidentensymposium. Auf diese Weise bleibt das immunologische Gedächtnis erhalten.1
Die Tolerabilität der CAR-T-Zell-Therapien wurde aufgrund der Erfahrungen aus der Hämatoonkologie zu Beginn kritisch beurteilt, weil es zu Fällen eines schweren Zytokinfreisetzungssyndroms (CRS) kam. Schett: „Der Unterschied zwischen Hämatologie und Autoimmunität ist jedoch, dass wir es bei der Hämatologie mit viel mehr B-Zellen zu tun haben und damit die Aktivierungen der CAR-T-Zellen weitaus massiver ist als bei Autoimmunprozessen.“ Bei den 40 Patient:innen mit Autoimmunerkrankungen, die in einer Pilotstudie von Schett et al. behandelt wurden, traten keine CRS von Grad 3 oder 4 auf, sondern lediglich von Grad 1 oder 2. Erfreulich war, dass keine Immun-Effektorzell-assoziierte Neurotoxizitätssyndrome (ICNS) auftraten. Aufgrund des guten Sicherheitsprofils der CAR-T-Zellen wurden in einer weiteren Studie 23 pädiatrische Patient:innen mit schwerem systemischem Lupus erythematodes (SLE) erfolgreich mit CD19-CAR-T-Zellen behandelt. Schett: „Die Nierenglobuli waren frei von Immunglobulinablagerungen.“ CAR-T-Zellen sind auch ZNS-gängig. Erste Erfahrungen mit CD19- und BCMA-gerichteten CAR-T-Zell-Therapien bei intensiv vorbehandelten Patient:innen mit Myasthenia gravis und schweren Myositiden sind positiv. Dies zeigt Rheumatologen, „dass CAR-T-Zell-Therapien auch im Gehirn B-Zell-Nester ausmerzen können“.
Alzheimer-Risikofaktoren – sinnvolle Prophylaxe ist möglich
Eine zeitgemäße Behandlung der Alzheimerdemenz sollte im Rahmen eines multimodalen Therapieansatzes auch eine Demenzprävention einschließen, stellte Prof. Agnes Flöel, Greifswald, fest.9 Dabei sind rund 45% der bislang identifizierten Risikofaktoren modifizierbar, so die Neurologin. Die Risikoreduktion beruht vor allem auf vier Mechanismen:
-
Verringerung vaskulärer Schädigungen
-
Reduktion der demenziellen Neuropathologie
-
Reduktion von Stress und Entzündungsprozessen
-
Aufbau einer kognitiven und neurologischen Hirnreserve
Günstig für die Demenzprävention bei den meisten Risikofaktoren ist, dass sie frühzeitig im mittleren Lebensabschnitt beginnen kann. Das betrifft vor allem den Alkoholkonsum, die Kontrolle der Blutzuckerwerte sowie des Blutdrucks. Weitere beeinflussbare Risikofaktoren sind physische Inaktivität, Depressionen und Übergewicht. Als neue Risikofaktoren nennt die 2023 aktualisierte S3-Leitlinie Demenzen der DGN ein hohes LDL-Cholesterin (>3,3mmol/l) sowie Sehverlust.4 Im höheren Lebensalter zeigen Studien, dass bei Schwerhörigkeit eine adäquate Hörgeräteversorgung das Demenzrisiko wirksam senkt. Ebenso wichtig sind soziale Kontakte. „Soziale Vereinsamung lässt das Demenzrisiko deutlich ansteigen“, so Flöel.
Für eine erste klinische Testung im Verdachtsfall empfahl Prof. Dorothee Saur, Leipzig, den MoCA (Montreal Cognitive Assessment), der in 10 Minuten durchführbar ist. Zur Diagnosestellung empfiehlt die neue S3-Leitlinie auch die Bestimmung von Biomarkern. Mit Liquor-Biomarkern können Pathologien im Bereich der Amyloide und der Tau-Proteine nachgewiesen werden, auch wenn die Symptomatik noch nicht voll ausgeprägt ist, so Prof. Richard Dodel, Duisburg-Essen. Favorisiert wird hier derzeit die Amyloid-Aβ1–40/1–42-Ratio sowie das Phospho-Tau (pTau) 181. Die Zukunft der Blutbiomarker wie pTau217 wird besonders die frühe Demenzdiagnostik bei ersten kognitiven Einschränkungen erleichtern.
Alzheimertherapie und -diagnose
Derzeit laufen weltweit 187 Alzheimer-Therapiestudien, berichtete Prof. Kathrin Reetz, Aachen. Davon sind 32 Wirkstoff-Kandidaten in Phase-III-Studien. Zum Zeitpunkt des DGN stand die zweite Sitzung der europäischen Zulassungsbehörde EMA zur Zulassung von Lecanemab zur Therapie der Alzheimerdemenz noch aus, es galt damals noch der negative Bescheid. Begleitend hierzu wurde auf dem DGN zwar nicht offiziell in den Sitzungen, aber im persönlichen Gespräch ein Thema diskutiert, das in den USA für Kontroversen sorgt: Kann eine Alzheimerdemenz künftig auch rein auf der Basis von Biomarker-Befunden diagnostiziert werden, wie es eine Arbeitsgruppe der Alzheimer’s Association (AA) 2024 vorgeschlagen hatte und von zahlreichen Arbeitsgruppen unterstützt wird? Kritik gegen dieses Konzept wurde bereits kürzlich auf dem CTAD-Kongress (Clinical Trials on Alzheimer’s Disease) in Madrid geäußert. Die Gegner einer rein Biomarker-basierten Diagnose, die dann auch bei symptomlosen Patient:innen erfolgen würde, sehen die Alzheimerdemenz vielmehr als eine klinisch-biologische Entität, bei der die Diagnose klinisch, aber auch unter Berücksichtigung der Biomarker-Befunde erfolgt. Damit würde eine Diagnose auch bei Patient:innen mit milden kognitiven Beeinträchtigungen möglich.2,3 Ein anlassloses Screening mittels Kurztests wird von der neuen DGN-S3-Leitlinie nicht empfohlen.4
Post-Covid – neurologische Korrelate und Perspektiven
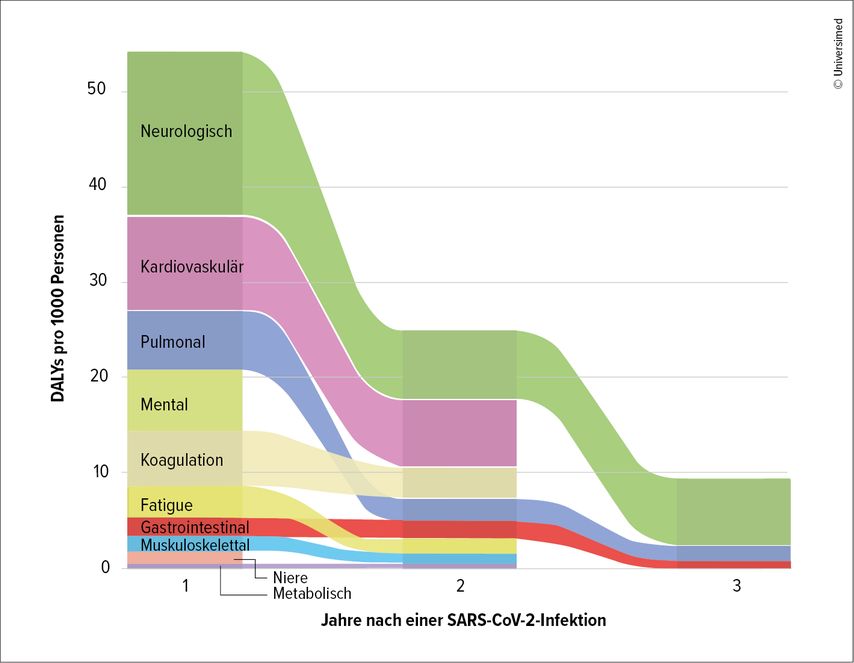
Die Diagnose eines Post-Covid-Syndroms (PCS) umfasst zahlreiche unterschiedliche klinische Symptome sowie immunologische, neurologische und vaskuläre Veränderungen. Das PCS bleibt eine Ausschlussdiagnose, wobei die Prävalenz mit 6–10% je nach Länge des zeitlichen Verlaufs geringer ist als bisher angenommen. Ein PCS kann sowohl nach leichten als auch nach schweren Verläufen auftreten. Zu den Kernsymptomen gehört insbesondere eine Fatigue, die mit kognitiven Defiziten („brain fog“) und Schmerzen sowie ängstlich-depressiven Symptomen einhergehen kann, so Prof. Michael Jöbges, Konstanz.5 Etwa 15–30% der Betroffenen leiden an kardialen Dysautonomien. Im Langzeitverlauf zeigt sich nach neueren Befunden insgesamt eine gute Besserung,6 auch wenn eine Subgruppe anhaltende Beeinträchtigungen, insbesondere neurologische Symptome, pulmonale und gastroenterologische Symptome, zeigt (Abb. 1).7
Abb. 1: Verlorene oder beeinträchtigte Lebensjahre (DALYs) durch Symptome eines Post-Covid-Syndroms (modifiziert nach Walders J 2024)7
Die Bildgebung zeigt, dass die Hirnaktivität von Patient:innen mit einem Long-Covid-Syndrom sich von jener von gesunden Individuen unterscheidet. Veränderungen sind auch bei nach Covid-19-Infektion asymptomatischen Personen nachweisbar. Neue Befunde in Post-mortem-Studien zeigen auffällige knötchenartige Mikrogliaaktivierungen mit einem sehr geringen Anteil von CD8+ T-Zellen als Hinweis auf eine chronische Aktivierung des angeborenen Immunsystems. Veränderungen der retinalen Mikrozirkulation sind möglicherweise ein Biomarker einer Endotheldysfunktion. Persistierende Komplementaktivierungen bei Patient:innen mit Gerinnungsstörungen könnten als Erklärung für Gerinnungsstörungen mit neuronalen Schädigungen ein Marker für ein Long-Covid-Syndrom sein.
Noch keine spezifischen Diagnosetests verfügbar
In den zahlreichen durchgeführten Biomarker-Studien wurden einige Kandidaten identifiziert, allerdings gibt es noch keine spezifischen Diagnosetests. Die in einer US-Studie bereits als Immunsignatur vorgestellte Zytokintriade mit Interleukin 6 (IL-6), TNF-alpha und niedrigem Serumcortisol ließ sich in einer deutschen Studienkohorte nicht replizieren. Bereits kommerziell verfügbare Tests sind laut Dr. Julia Walders, Aachen, nicht aussagekräftig.7
Klinisch bewirken die vermehrte kognitive Belastung und eine emotionale Aktivierung eine Zunahme von Erschöpfung bei PCS-Patienten, berichtete Melanie Tempfli, Konstanz. Die Pathogenese einer Fatigue nach Covid-19 ist ebenso wie der natürliche Verlauf noch unklar. Fatigue-Symptome können beim PCS bis hin zum Vollbild eines postinfektiösen chronischen Fatigue-Syndroms (CFS; ICD-10 G93.3) auftreten.8 Bisher ist noch keine kausale Therapie bekannt. Sind ambulante Maßnahmen nicht ausreichend, kann eine (teil)stationäre Rehabilitation erwogen werden. Jöbges stellte hierzu die Ergebnisse der prospektiven Kohortenstudie PoCoRe zum Verlauf eines PCS bei insgesamt 1028 Patienten (72% Frauen; im Mittel 49,5 Jahre; im Mittel 29 Monate seit der Akutinfektion) während einer 5-wöchigen Rehabilitation vor. Auffällig war die hohe Fatigue-Prävalenz bei Aufnahme (84,6%) und Entlassung (77,4%). Die Symptomatik verringerte sich im Rehaverlauf mit niedriger bis mittlerer Effektstärke.2
Quelle:
97. Jahrestagung der Deutschen Gesellschaft für Neurologie (DGN) vom 6.–9. November 2024 in Berlin
Literatur:
1 Präsidentensymposium „Immunologie ohne Grenzen“. DGN, 7.11.2024 2 Dubois et al.: Alzheimer disease as a clinical-biological construct. An international working group recommendation. JAMA Neurol 2024; doi: 10.1001/jamaneurol.2024.3770 3 Petersen RC et al.: Alzheimer disease - what’s in a name? JAMA Neurol 2024; doi: 10.1001/jamaneurol.2024.3766. Online ahead of print 4 DGN-S3-Leitline Demenzen. https://register.awmf.org/assets/guidelines/038-013l_S3_Demenzen-2023-11_1.pdf 5 Jöbges M: Symposium „Post-COVID-19-Zustand – ein kritischer Diskurs zwischen wissenschaftlicher Evidenz und klinischer Praxis“. DGN, 7.11.2024 6 Servier C et al.: Trajectories of the evolution of post-COVID-19 condition, up to two years after symptoms onset. Int J Infect Dis 2023; 133: 67-74 7 Walders J: „Post-COVID-19-Zustand – ein kritischer Diskurs zwischen wissenschaftlicher Evidenz und klinischer Praxis“. DGN, 7.11.2024 8 Tempfli M: Symposium „Fatigue bei Post-COVID: neuro-psychologische Korrelate und Perspektiven“. DGN, 8.11.2024 9 Sitzung „Kognitive Störungen und Demenzen“. DGN, 7.11.2024
Das könnte Sie auch interessieren:
Die Schlacht der Bruton-Tyrosinkinase-Inhibitoren – Tolebrutinib im Ziel?
Der orale liquorgängige Bruton-Tyrosinkinase(BTK)-Inhibitor Tolebrutinib erreichte in der Phase-III-Studie HERCULES den primären Endpunkt. Die Studienergebnisse wurden erstmals beim ...
Parkinson: Wie beeinflussen Luftverschmutzung, Lösungsmittel und Pestizide das Risiko?
Bereits bei der Erstbeschreibung der Parkinsonkrankheit (PK) im 18.Jahrhundert in London glaubte man, dass die Umweltverschmutzung eine Rolle bei der Entstehung von der PK spiele. Die „ ...
Migräne: nicht zu lange mit den Anti-CGRP-Antikörpern warten
Sowohl zu den Anti-CGRP-Antikörpern als auch zu den Gepanten wurde im vergangenen Jahr eine Vielzahl an Studien publiziert. Die Daten sprechen unter anderem dafür, dass die monoklonalen ...