Die Mykobakterien-Challenge – welches TBC-Medikament wirkt wo warum?
Autorin:
Priv.-Doz. MMag. pharm.
Dr. Irene Lagoja,aHPh,
akad. HCM
Anstaltsapotheke Klinik Ottakring, Wien
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Abgesehen von der langen Therapiedauer sieht man sich in der Behandlung der Tuberkulose mit drei großen Herausforderungen konfrontiert: den für dieses Bakterium typischen Eigenschaften, der Resistenzbildung und dem aufgrund unterschiedlicher Infektionsherde (z.B. ZNS, Lunge, Knochen, Weichteile) sehr divergenten Krankheitsbild, an das die antibiotische Therapie angepasst werden muss.
Keypoints
-
Durch mehrere physiologische Herausforderungen, Subpopulationen von Mykobakterien, die wachsartige Bakterienzellwand und die Neigung zur Resistenzbildung wird eine Tuberkulosetherapie immer als Kombination mehrerer Antibiotika eingesetzt.
-
Mykobakterien befallen unterschiedliche Organe bzw. Strukturen, weshalb die Antibiotikatherapie so gewählt werden muss, dass die Bakterienreservoire erreicht werden.
-
Die Tuberkulosetherapie umfasst immer Kombinationen aus bakteriostatischen und bakteriziden Antibiotika mit unterschiedlichen Angriffspunkten im Zellzyklus des Mykobakteriums.
Tuberkulöse Granulome und Verkalkungen sind oft schlecht durchblutet, was die Penetration der Medikamente erschwert. Auch die wachsartige Zellwand von Mykobakterien stellt eine zusätzliche Barriere dar. In verkäsenden Nekrosen und in Makrophagen herrscht oft ein saures Milieu, während andere Bereiche neutral oder leicht alkalisch sein können. Die Wirksamkeit der Antituberkulotika ist pH-abhängig. Weiters gibt es in einem Tuberkuloseherd unterschiedliche Populationen von Mykobakterien: In gut durchbluteten, sauerstoffreichen Bereichen existieren schnell proliferierende Keime, während in schlecht durchbluteten, hypoxischen und sauren Regionen langsam wachsende oder ruhende Keime vorkommen. Das heißt, Antibiotika einer Tuberkulosetherapie müssen gegen verschiedene bakterielle Subpopulationen und unter unterschiedlichen physiologischen Bedingungen wirken.
Resistenzbildung
Zu diesen physiologischen Herausforderungen kommt die Neigung zur Resistenzbildung während der oft doch recht langwierigen Behandlung. Die wachsartige, fettreiche Zellwand von M. tuberculosis ist ohnehin schwer durchlässig. Mutationen oder Veränderungen in Transportproteinen können die Aufnahme von Antibiotika weiter erschweren. Bestimmte Enzyme (z.B. Betalaktamasen, Acetyltransferasen) können Antibiotika direkt abbauen oder modifizieren und so unwirksam machen. Durch Überexpression von Effluxpumpen werden Antibiotika aktiv aus den Zellen transportiert, wodurch die intrazelluläre Konzentration unter die wirksame Schwelle sinkt. M. tuberculosis kann in einen Ruhezustand (Dormanz) übergehen, bei dem viele Stoffwechselwege heruntergefahren werden. Da viele Antibiotika nur auf aktive Prozesse wirken, sind ruhende Bakterien weniger angreifbar.
Genetische Mutationen betreffen meist die Zielstrukturen der Antibiotika (z.B. Enzyme, Ribosomen) oder deren Aktivierungsmechanismen. Da viele Tuberkulosemedikamente Prodrugs sind, können Mutationen in aktivierenden Enzymen (z.B. KatG bei Isoniazid, rpoB-Genregion für Rifampicin) zur Resistenz führen. Zu diesen in der Natur vorkommenden Mechanismen der Resistenzbildung kommen „hausgemachte“ Resistenzen durch unsachgemäße Therapie (Monotherapie, Interaktionen, zu kurze Behandlungsdauer, unregelmäßige Einnahme), da hier nur empfindliche Stämme abgetötet werden und resistente Stämme überleben.
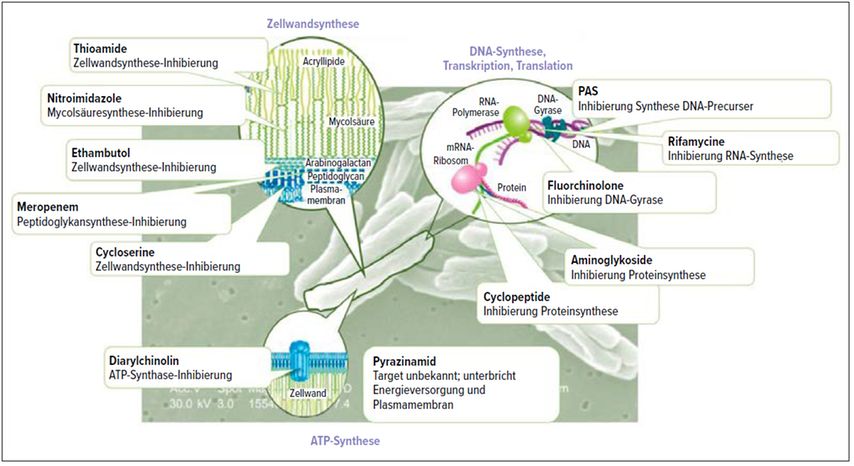
Aus oben genannten Gründen wird eine Tuberkulosetherapie immer als Kombinationstherapie geführt. Die gewählten Wirkstoffe haben unterschiedliche Angriffsorte im Mykobakterium (Abb.1).
Abb. 1: Tuberkulosemedikamente und Wirkmechanismen (modifiziert nach National Institute of Allergy and Infectious Diseases, NIAID, 2016)
Antibiotische Therapie
Mykobakterien können unterschiedliche Organe befallen, deshalb muss die antibiotische Therapie so gewählt werden, dass folgende Bakterienreservoire erreicht werden:
Weichteile
Für die Therapie der Weichteiltuberkulose (z.B. Haut, Muskeln, subkutanes Gewebe) muss ein Antibiotikum ausreichend ins Weichteilgewebe penetrieren, gegen langsam wachsende und intrazellulär persistierende Mykobakterien wirksam sein, bakterizid wirken, ein günstiges pharmakokinetisches Profil aufweisen sowie in Kombinationstherapie einsetzbar sein, um Resistenzentwicklung zu vermeiden. Diese Anforderungen erfüllen die in den Leitlinien empfohlenen Standardmedikamente (Isoniazid, Rifampicin, Pyrazinamid, Ethambutol) und – bei Resistenzen – auch die Reserveantibiotika.
Intrazellulärer Raum
Im intrazellulären Raum, d.h. in Makrophagen und anderen Immunzellen, können Bakterien aktiv und lebensfähig vorkommen. Rifampicin ist sowohl im extrazellulären als auch im intrazellulären Raum hochwirksam, penetriert Makrophagen gut und wirkt dort bakterizid gegen intrazellulär persistierende Mykobakterien. Pyrazinamid entfaltet seine Wirkung besonders im sauren Milieu, wie es in phagozytierenden Zellen und nekrotischen Gewebebereichen vorliegt. Es ist daher für die Elimination intrazellulärer und ruhender Keime besonders wichtig. Isoniazid wirkt sowohl extrazellulär als auch intrazellulär, insbesondere gegen schnell wachsende Mykobakterien, die sich in Zellen teilen. Ethambutol wirkt primär extrazellulär und hat eine geringere Aktivität im intrazellulären Raum, wird aber in der Initialphase zur Resistenzvermeidung mit eingesetzt. Linezolid wirkt sehr gut intrazellulär und wird in modernen MDR/XDR-Regimen eingesetzt. Bedaquilin zeigt Aktivität gegen Mykobakterien in verschiedenen Kompartimenten, einschließlich intrazellulärer Lokalisation. Fluorchinolone wie Moxifloxacin sind ebenfalls in der Lage, intrazellulär wirksam zu sein.
Extrazellulärer Raum
Der extrazelluläre Raum unterscheidet gut durchblutete Gewebe (z.B. Kavernen der Lunge) mit meist sehr aktiven Bakterien und verkäsende Nekrosen wie granulomatöse Läsionen, bei denen Bakterien häufig im ruhenden oder langsam wachsenden Zustand vorkommen. Bei „käsigen“ Verkapselungen und fibrotischen Arealen handelt es sich ebenfalls um schlecht durchblutete Bereiche, die Bakterien sind schwer erreichbar, die Penetration vieler Antibiotika ist eingeschränkt.
Grundsätzlich sind zur Behandlung einer extrazellulären Tuberkulose die drei Basiswirkstoffe Isoniazid (INH), Rifampicin (RMP) und Ethambutol (EMB) sehr gut geeignet. Für MDR- und XDR-TB werden folgende Medikamente mit guter extrazellulärer Wirksamkeit eingesetzt:
-
Moxifloxacin (bzw. andere Fluorchinolone) haben eine sehr gute Penetration und bakterizide Wirkung.
-
Bedaquilin zeigt hohe Aktivität gegen Mykobakterien, insbesondere im extrazellulären Milieu, es ist zentraler Bestandteil moderner MDR/XDR-Therapien (z.B. BPaLM-Regime).
-
Linezolid wirkt sowohl intra- als auch extrazellulär, es wird vor allem wegen seiner guten Gewebepenetration und Aktivität gegen persistierende Bakterien eingesetzt. Pretomanid zeigt ebenfalls Aktivität im extrazellulären Raum und ist Bestandteil der neuen Kombinationsregime.
-
Clofazimin und Cycloserin werden bei bestimmten Resistenzmustern eingesetzt, wirken aber weniger ausgeprägt extrazellulär als die oben genannten Substanzen.
Knochen- und Gelenkgewebe
Bei osteoartikulärer Tuberkulose ist eine gute Penetration in schlecht durchblutetes Knochengewebe nötig. Neben einer geringen Molekülgröße sind gute Lipidlöslichkeit, geringe Proteinbindung, gute Gewebspenetration, Aktivität gegen intrazelluläre Erreger, Wirksamkeit bei Biofilmen (minimale Hemmkonzentration bis zu 50x höher; betrifft nicht nur Knochen, sondern auch Implantate und kavernöse Nekrosen) sowie nicht Laktamase-empfindliche Antibiotika für gute Knochengängigkeit essenziell. Ebenfalls wichtig sind eine hohe Bioverfügbarkeit (p.o. und i.v.) und aufgrund der langen Therapiedauer auch eine gute Langzeitverträglichkeit. In den Leitlinien wird bei medikamentensensiblen Erkrankungen die Behandlung mit Isoniazid, Rifampicin, Pyrazinamid und Ethambutol empfohlen, bei Monoresistenzen werden drei Standardmedikamente plus Streptomycin oder Fluorchinolon, bei MDR- und XDR-Tuberkulosen Bedaquilin, Pretomanid, Linezolid, Moxifloxacin (BPaLM) und ggf. weitere Zweitrangmedikamente empfohlen. Die Auswahl und Kombination richten sich immer nach dem individuellen Resistenzprofil und der Verträglichkeit.
Liquorraum/Zentralnervensystem
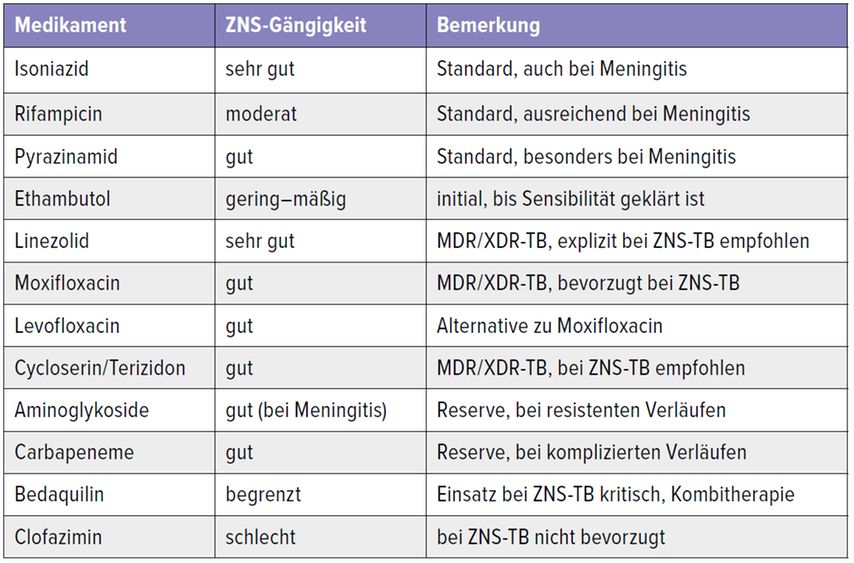
Antibiotika müssen die Blut-Hirn-Schranke überwinden und im Liquor ausreichende Konzentrationen erreichen. Die ZNS-Gängigkeit dieser Medikamente beruht auf geringer Molekülgröße, guter Wasserlöslichkeit, geringer bis moderater Proteinbindung und veränderter Durchlässigkeit der Blut-Hirn-Schranke bei Entzündung. Dadurch können sie im ZNS therapeutisch wirksame Konzentrationen erreichen und sind essenziell für die Therapie der tuberkulösen Meningitis. Tabelle 1 fasst die ZNS-Gängigkeit der wichtigsten Antituberkulotika zusammen.
Literatur:
● Fachinformationen der jeweiligen Wirkstoffe ● DreyerV et al.: Tuberkulose wird widerstandsfähiger. Extreme Antibiotikaresistenz. https://www.laborpraxis.vogel.de/extreme-antibiotikaresistenz-a-a005eebf424f5be7d385549660f 0920a ; zuletzt aufgerufen am 8.7.2025 ● Feiterna-Sperling C, Brinkmann F: S2k-Leitlinie zur Diagnostik, Prävention und Therapie der Tuberkulose im Kindes- und Jugendalter. Eine Leitlinie im Auftrag der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI). Pneumologie 2017; 71(10): 629-80. https://www.dzk-tuberkulose.de/aerzte/leitlinien-und-empfehlungen/; zuletzt aufgerufen am 8.7.2025 ● Hauer B et al.: Resistente Tuberkulose: Zunehmende Probleme und Lösungsansätze. Pneumologie 2011; 8: 25-31 ● Loddenkemper R, Hauer B: Resistente Tuberkulose: Große Herausforderung durch eine Weltepidemie. Dtsch Arztebl Int 2010; 107(1-2): 10-9 ● Otto-Knapp R et al.: Therapie bei MDR-, prä-XDR-, XDR-Tuberkulose und Rifampicin-Resistenz oder bei Medikamentenunverträglichkeit gegenüber mindestens Rifampicin. Pneumologie 2023; 78(1): 35-46 ● Schaberg T et al.: Tuberkulose im Erwachsenenalter. Eine S2k-Leitlinie zur Diagnostik und Therapie, einschließlich Chemoprävention und -prophylaxe der Tuberkulose im Erwachsenenalter. https://www.dzk-tuberkulose.de/aerzte/leitlinien-und-empfehlungen/; zuletzt aufgerufen am 8.7.2025 ●Trumm A: Die Resistenzentwicklung des Tuberkuloseerregers. Disseration, LMU München 2010; https://edoc.ub.uni-muenchen.de/11832/ 1/Trumm_Anja.pdf ; zuletzt aufgerufen am 8.7.2025 ● World Health Organization: Global Tuberculosis Reports. https://www.who.int/teams/global-tuberculosis-programme/tb-reports ; zuletzt aufgerufen am 8.7.2025 ● World Health Organization: Meeting report of the WHO expert consultation on the definition of extensively drug-resistant tuberculosis, 27-29 October 2020. World Health Organization 2021; https://www.who.int/publications/i/item/9789240018662 ; zuletzt aufgerufen am 8.7.2025
Das könnte Sie auch interessieren:
Neue Daten vom EAACI-Kongress 2025
Der Kongress der European Academy of Allergy and Clinical Immunology (EAACI) fand dieses Jahr in Glasgow statt. Dabei wurden allergologische und immunologische Updates aus den ...
Best of DGP: Kongress-Highlights für die Praxis
Dr. Sabine Lampert, niedergelassene Pneumologin in Erlangen, fasste die Erkenntnisse vom DGP-Kongress 2025 für die tägliche Praxis zusammen. Sie konzentrierte sich bei ihrem „Best of DGP ...